El hecho de que los investigadores científicos impartan clases a los alumnos, es la mejor manera de que la ciencia se transmita directamente sin ningún tipo de intermediarios que puedan modificar la información. Los investigadores científicos, como J.J Thomson, transmiten sus observaciones, experimentos, hipótesis etc, a sus alumnos manteniendo la ciencia en un crecimiento constante. Todo aquello realizado por el profesor puede ser un acicate para que los alumnos entren en el mundo de la investigación científica y terminar o modificar lo que comenzaron sus profesores, como Rutherford.
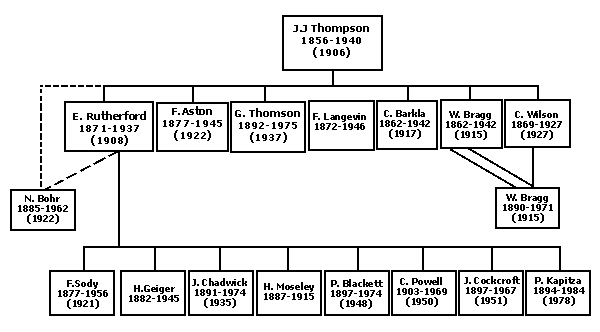
Esta imagen representa el árbol genealógico de maestros empezando J.J Thomson. Las fechas entre paréntesis representan los años en los que ganaron el premio Nobel.
Por ejemplo hoy en día muchos de los licenciados en ciencias se quedan como trabajadores en la universidad, investigando, impartiendo clases o dirigiendo parte de ella, algunos de ellos son Alfredo Poves, Luisa Bausá López, Sebastián Vieira Díaz... Cada uno de ellos, con su esfuerzo y trabajo, consiguen que mundo de la ciencia se mantenga vivo y que nos ayude a mejorar poco a poco nuestro día a día.
2.
Tanto la física como la química son ciencias que estudian la materia. La fisica es la que se encarga de estudiar sus las propiedades y de la energía mientras que la química se encarga de estudiar los cambios internos que se producen en ella. Cuando se produce un cambio físico la sustancia sigue manteniendo su naturaleza y propiedades esenciales, mientras que en un cambo químico las sustancias se transforman en otras distintas.
Un ejemplo muy sencillo, sería cuando doblas o cortar un papel, este cambia su aspecto pero sigue conservando sus propiedades, pero si lo quemas al final no queda papel, solo cenizas y humo, eso sería un cambio químico.
En esta página aparecen más ejemplos y explica muy bien la diferencia que hay entre la química y la física
"Toda ciencia, o es Física, o es coleccionismo de sellos"
Según estas palabras, detectar y contar alfas individualmente se parecía más al coleccionismo que a la física, una mera clasificación que no le llevaría a nada. Lo que supuso una contracción a su trabajo, ya que en 1908 ganó el premio Nobel de química por sus investigaciones sobre la desintegración de los elementos y la química de las sustancias radiactivas. A raíz de este galardón, Rutherford pronunció las siguientes palabras: "He cambiado muchas veces en mi vida, pero nunca de manera tan brusca como en esta metamorfosis de físico a químico"
Estas palabras palabras reflejan la ironía de Rutherford por haber recibido un nobel de una materia que el no consideraba tan útil como la física
3.
Nikola Tesla era un genio asombroso, visionario y muy inteligente, pero poco conocido e incapaz de obtener beneficio de sus tan importantes creaciones. Pocos de sus inventos son reconocidos como suyos, pero son todavía hoy muy prácticos y funcionales y se consideran los cimientos de las civilizaciones avanzadas tecnológicamente.

Por ejemplo, prácticamente todo lo que hoy utiliza electromagnetismo está derivado de las patentes originales de Tesla. Su aportación más importante fue la de la corriente alterna, un sistema para enviar energía eléctrica sin cables a largas distancias.Pero además del electromagnetismo, su trabajo abarca campos como la ingeniería eléctrica robótica, balística, y la física nuclear y teórica. En total, Tesla patentó más de 700 inventos, entre los que cabe destacar la lámpara fluorescente, el láser más básico, la “Bobina de Tesla”, la radio, el submarino eléctrico, la comunicación inalámbrica, el control remoto, el motor eléctrico moderno y sus estudios sobre rayos X.
Click aquí para leer como es posible construir una bobina de Tesla.
Al ser un tanto peculiar, mantuvo una serie de disputas científicas con otros personajes de la época, que "hicieron suyos" trabajos llevados a cabo por él.
A los 28 años, Tesla se trasladó a vivir a Nueva York, donde trabajó con Edison. Estaba interesado en el estudio de la corriente alterna, algo que Edison veía como competencia a las instalaciones de corriente continua que él había creado. Aún así, le contrató con el fin de que mejorara los diseños de esos generadores de corriente continua. Tesla se dedicó a esta tarea durante casi un año, proporcionando a Edison nuevas y diversas patentes. Pero cuando alcanzó los objetivos propuestos, Edison se negó a pagarle la recompensa prometida y a subirle el sueldo lo más mínimo, lo que hizo que Tesla dimitiera.
A partir de entonces se dedicó a trabajar en el desarrollo de los componentes necesarios para generar y transportar la corriente alterna a largas distancias. Desarrolló las bobinas y el motor eléctrico. Entonces fue cuando comenzó la llamada Guerra de las Corrientes entre Tesla y Edison. Este último quería imponer su sistema de corriente continua, mientras que Tesla proponía utilizar la corriente alterna, mucho más fácil de transformar. Pero la corriente alterna era una mejor alternativa y acabaría imponiéndose.

Tesla siguió con sus inventos e investigaciones, esta vez centrándose en las ondas de radio y las altas frecuencias. Ese fue el comienzo de su gran obsesión: conseguir la transmisión inalámbrica de energía.
Pero en 1909 el italiano Marconi gana el premio Nobel por su aparato de radio, que utilizaba un gran número de patentes propiedad de Tesla.
En sus últimos años de vida, Tesla se dedicó a continuar con su gran sueño de transmitir energía sin cables, para distribuirla libremente por todo el planeta. Pero nunca se llevó a cabo ninguno sus últimos proyectos, por falta de presupuesto e interés. Muere en 1943.
4.
A) La fluorescencia es el fenómeno que hace que algunas sustancias emitan una luz más o menos azulada al ser estimuladas por una radiación externa. En este tipo de sustancias estaban presentes siempre átomos de flúor.
En cambio, la fosforescencia hace que algunas sustancias en las que hay átomos de fósforo, sigan emitiendo una luz verdosa incluso después de estar siendo iluminadas. La familia Becquerel llevaba muchas generaciones experimentando con sustancias fosforescentes. La obsesión de uno de los miembros de esta familia de científicos se centró en intentar fotografiar con luz fosforescente. Se dedicó a fotografiar diferentes objetos en placas fotográficas con sales de uranio (fosforescentes), exponiéndolas al sol intenso, metiéndolas en un cajón oscuro... Al final, llegó a la conclusión de que las sales de uranio emitían rayos que no tenían nada que ver con la fosforescencia.
Por tanto, lo que básicamente diferencia a la fluorescencia de la fosforescencia es que la primera necesita de una fuente de rayos ultravioletas para emitir luz, mientras que la fosforescencia sigue emitiendo esa luz después de estar siendo iluminadas.
B) Los Rayos X son aquellas radiaciones invisibles que son penetrables en ciertos cuerpos opacos como la piel, tejido, etc. y con ellos es posible realizar fotografías con, casi siempre, fines médicos.
Estos rayos fueron descubiertos por Wilhelm Röntgen en 1895, éste mientras experimentaba con los rayos catódicos observó una radiación que surgía del ánodo con unas propiedades especiales. Primero se llamaron rayos incógnita, al no saber qué eran, y más tarde fueron nombrados Rayos X.
Después, algunos científicos como Becquerel, Rutherford… empezaron a trabajar con estas radiaciones, gracias a las cuales se lograron muchos otros descubrimientos.
Animación sobre la interacción de los Rayos X con la materia
C) Joliot y Marie Curie fueron los científicos descubridores de la radiactividad, al darse cuenta de que muchas sustancias emitían rayos que sólo podían provenir de sus átomos. Aunque este fenómeno ya había sido descubierto en realidad por el miembro de la familia de los Becquerel que hemos nombrado antes, pero se desconocía su procedencia exacta.
Consistía en la desintegración espontánea de algunos átomos pesados, manifestándose en tres tipos de emisiones, alfa, beta y gamma.
D)La aportación de estos científicos fue muy importante, el matrimonio Curie demostró que una serie de sustancias contenían radiactividad y Rutherford le encontró varias aplicaciones a esta radiactividad, gracias a lo que fue capaz de descubrir el núcleo atómico. Así, quedó aclarada la procedencia de esa radiactividad descubierta, casi sin darse cuenta por Becquerel y su experimento adquirió mucha más importancia.

E)Las radiaciones alfa, beta y gamma son tres tipos de emisiones en las que se manifiesta la descomposición atómica en la que consistía la radiactividad, diferenciándose en sus propiedades energéticas y su composición.
A continuación, se encuentran ordenadas enérgicamente de menor a mayor.
Partículas alfa (α): formadas por átomos de Helio y por dos protones y dos neutrones. Al carecer de electrones, su carga eléctrica es positiva. Son el tipo de partículas menos penetrantes, ya que ni siquiera son capaces de atravesar la piel humana. Son las partículas lanzadas por Rutherford y su discípulo Geiger en el experimento en el que las hacen incidir sobre una lámina de oro.

Partículas beta (β): formadas por electrones. Son capaces de penetrar un poco más que las partículas alfa (madera o metal fino).

Rayos gamma (γ): radiación electromagnética y muy energética, convirtiéndose en el tipo de radiación más penetrante. Sólo es capaz de detenerlas un pared de plomo o cemento. Por eso su experimento, Rutherford, Geiger y Marsden, lo realizaban en un contenedor de plomo, porque era lo único que detenía a la radiación gamma.

Animación en la que se puede observar la capacidad de penetración, y por lo tanto la energía de estos tres tipos de emisiones radiactivas.

F)La ley de desintegración atómica determina el ritmo al que se desintegran los elementos radiactivos. Se utilizan como método de datación geológica porque su vida media es muy variable, y la ley de desintegración atómica puede predecir su velocidad de desintegración para más tarde ser medida.
INVESTIGACIÓN: CARBONO CATORCE
El Carbono-14, es un isótopo del carbono. Posee 8 protones y 6 neutrones, el carbono corriente (Carbono12) posee 6 protones y 6 neutrones . Su presencia en los materiales orgánicos es la base que se utiliza hoy en día para poner fecha a muestras arqueológicas y geológicas.
¿Y cómo funciona? Las plantas ajustan el carbono atmosférico durante la fotosíntesis, así que el nivel en las plantas y los animales cuando mueren es similar al de la atmósfera en ese momento, por lo que conociendo la cantidad de Carbono 14 contenida en el objeto que queremos datar, puede determinarse la fecha de la muerte.

G)Un contador Geiger es un instrumento que permite medir la radiactividad de un objeto o de un lugar. Está formado por un tubo con un fino hilo metálico a lo largo de todo su centro. El espacio entre ellos se encuentra aislado y relleno de un gas.
Un ion o un electrón penetra en el tubo y desprende electrones de los átomos del gas. Cada partícula que pasa por el contador produce un pulso idéntico, permitiendo contar las partículas pero sin decirnos nada sobre su identidad o su energía. Debido al voltaje positivo del hilo central, los electrones son atraídos hacia éste. Al hacer esto ganan energía, colisionan con los átomos y liberan más electrones, hasta que el proceso se convierte en una «avalancha» que produce un pulso de corriente que podemos detectar.
El primer Contador Geiger, sólo detectaba partículas alfa y fue inventado por Geiger y Rutherford en 1908. A partir de ese momento, la técnica ha ido mejorando hasta llegar a la versión actual del contador, que fue desarrollada por el físico Sidney H. Liebson. Este dispositivo tiene una duración mayor que el dispositivo original y precisa menos voltaje.
Construye tu propio Contador Geiger aquí
5.Rutherford:
El experimento de la lámina de oro.
Este experimento fue realizado en Manchester en 1909. Los resultados obtenidos rectificaron el modelo atómico de Thomson,que explicaba el átomo como una masa de carga positiva con cargas negativas distribuidas en su volumen.

Modelo de puding con pasas de Thomson
Para realizar este experimento sobre una fina lámina de oro proyectaron un haz de rayos alfa, (núcleos completamente ionizados), es decir, sin sus electrones correspondientes. Para esto utilizaron el polonio como fuente de rayos alfa.

Rutherford pudo observar como dicha lámina afectaba a la trayectoria de los rayos.
Según el modelo de Thomson, las partículas alfa atravesarían la lámina metálica sin desviarse demasiado, ya que la carga positiva y los electrones se encontrarían dispersos por el volumen del átomo. Las partículas alfa poseen una gran masa, por lo que se pensó que las fuerzas eléctricas resultarían insuficientes para conseguir desviar estas partículas.
Pero Rutherford se dio cuenta que un mínimo porcentaje de partículas se desviaban. Aproximadamente una de cada 8000 en una lámina de 200 átomos de espesor.
Describió este resultado así: "Tan sorprendente como si le disparases balas de cañón a una hoja de papel y rebotaran hacia ti".

Rutherford concluyó que el hecho de que la mayoría de las partículas atravesaran la hoja metálica, indica que gran parte del átomo está vacío, que la desviación de las partículas alfa indica que el deflector y las partículas poseen carga positiva, pues la desviación siempre es dispersa. Y el rebote de las partículas alfa indica un encuentro directo con una zona fuertemente positiva del átomo y a la vez muy densa.
Las pocas partículas que se desvían son las que llegan a las cercanías de los núcleos, como se puede apreciar en la siguiente imagen:

La siguiente imagen representa lo que tendría que ocurrir desde el punto de vista de Thomson y de Rutherford.

Completamente asombrado tras esta investigación, repitió el mismo procedimiento pero esta vez con una lámina de mica y observó que sólo ocurre esto con metales, en este caso se obtenía una deflexión de dichas partículas. Al retomar Geiger y Marsden (con los cuales trabajaba en la Universidad de Manchester) estos experimentos y utilizando una lámina de oro, se dieron cuenta de que algunas partículas alfa se desviaban más. Rutherford lanzó entonces la hipótesis de que en el centro del átomo debía haber un "núcleo" que contuviera casi toda la masa y toda la carga positiva del átomo, y que de hecho los electrones debían determinar el tamaño del átomo.
6. El modelo atómico de Rutherford:

Este modelo atómico que proponía Rutherford mantenía el planteamiento de Thomson, de que los átomos poseen electrones, pero su explicación sostenía que todo átomo estaba formado por un núcleo y una corteza. El núcleo debía tener carga positiva, un radio muy pequeño y en él se concentraba casi toda la masa del átomo. La corteza estaría formada por una nube de electrones que orbitan alrededor del núcleo.
Así mismo, también dijo que la materia es neutra, ya que la carga positiva del núcleo y la negativa de la corteza se neutralizan entre sí.
A Rutherford se le cosideró el padre de la interección nuclear, ya que gracias a el sabemos que la interacción nuclear fuerte obliga a los nucleos a permanecer unidos.
Antes de que Rutherford expusiera su modelo atómico se creía que un átomo era tal y como Thomson lo había descrito: Una pequeña esfera cargada positiva y negativamente. Con el experimento de "la lámina de oro" Rutherford y su alumno descubrieron el núcleo atómico y a partir de ahí, Rutherford expuso su modelo atómico. El átomo consta de un núcleo cargado positivamente, que contiene protones y neutrones, y alrededor de ese núcleo orbitan los electrones, con carga negativa. La suma de cargas negativas debe ser igual a la suma de cargas positivas, de ahí que los átomos sean neutros. Se podría decir que los átomos son como un sistema solar en miniatura. Rutherford dedujo que, al haber tantas partículas del mismo signo en un espacio tan reducido, tenía que haber una fuerza que los mantuviera unidos y unas partículas que suministraran dicha fuerza. Rutherford determinó la existencia la fuerza nuclear y la de los neutrones.
Descubrió los cuatro tipos de interacciones fundamentales conocidas:
1. Interacción nuclear fuerte: Es la que mantiene unidos los componentes de los núcleos atómicos, y actúa indistintamente entre protones o neutrones. Su alcance es del orden de las dimensiones nucleares, pero es más intensa que la fuerza electromagnética.
2. Interacción nuclear débil: La interacción nuclear débil o interacción débil es la responsable de los procesos sufridos por los leptones, partículas elementales caracterizadas por su baja masa. Como su propio nombre indica, es mucho más débil que la interacción fuerte, y los procesos mediados por esta fuerza son también mucho más lentos.
3. La interacción electromagnética: Actúa entre las sustancias con carga eléctrica. Es mucho mas fuerte que la gravitatoria y existe en la mayoría de los fenómenos cotidianos.
4. La interacción gravitatoria: Hace que cualquier tipo demateria que tenga energía interactúe entre sí. Si esa materia es positiva, tendrá un carácter atractivo.
7. Nuestro escudo científico:

La intención de este escudo es la de hacer comprender que la ciencia está en todas partes y que todo el mundo entiende de ella. Para considerarse científico no hay que tener un nobel o cualquier otro premio. Lo único que se necesita es la capacidad de interesarse por las cosas que nos rodean todos los días.










 que como cita el autor del libro, "Al final, quizá considere que lo de historia de la física podría quedar,simplemente, en Historia".
que como cita el autor del libro, "Al final, quizá considere que lo de historia de la física podría quedar,simplemente, en Historia". libro podemos observar a Einstein metido en la bañera, relacionando así un hecho antiguo, como es la anécdota de Arquímedes con la bañera y su famoso eureka, con Einstein un personaje más contemporáneo. A parte de ser una relación bastante interesante, es muy cómica por el mero hecho de ver a Einstein metido en una bañera sacando la lengua, como en una de sus fotos más famosas.
libro podemos observar a Einstein metido en la bañera, relacionando así un hecho antiguo, como es la anécdota de Arquímedes con la bañera y su famoso eureka, con Einstein un personaje más contemporáneo. A parte de ser una relación bastante interesante, es muy cómica por el mero hecho de ver a Einstein metido en una bañera sacando la lengua, como en una de sus fotos más famosas.




